La scoperta casuale delle penicilline nel 1928 da parte di Alexander Fleming costituisce il punto di partenza di una rivoluzione che ben presto riguarderà il mondo della medicina: l’introduzione degli antibiotici per la cura delle infezioni batteriche.
Penicilline, cefalosporine, carbapenem, macrolidi, licosammidi, tetracicline, cloramfenicolo etc… sono classi di molecole utilizzate come antibiotici con diversi target e meccanismi di azione.
Il loro utilizzo, in singolo o in combinazione, ad oggi è molto diffuso nel mondo. Da tempo si studia l’impatto di questi farmaci sul microbiota intestinale dei pazienti.
Scopriamo insieme il rapporto che lega il microbiota intestinale e gli antibiotici.
Riduzione della biodiversità microbica
Gli antibiotici sono molecole in grado di produrre una pesante perturbazione a livello del microbiota intestinale, dal momento che non esiste una molecola in grado di colpire con precisione solamente il patogeno che si intende eliminare con il suo utilizzo.
In molti studi scientifici è stata osservata la scomparsa e la riduzione di molte specie e generi batterici. In adulti, in seguito alla somministrazione di una combinazione di meropenem, gentamicina e vancomicina, è stata riscontrata una diminuzione delle specie butirrogene e appartenenti al genere Bifidobacterium, insieme ad un aumento delle Enterobacteriaceae e altre specie patobionti. Il microbiota ritorna alla sua composizione originale dopo circa un mese/un mese e mezzo dalla terapia antibiotica. Tuttavia, alcune specie presenti prima della terapia, non risultano presenti neanche dopo questo periodo.
E’ bene sottolineare che, in seguito alla somministrazione di un antibiotico, si osserva una diminuzione della biodiversità batterica, non strettamente correlata con il numero di batteri presenti nel microbiota. Molto spesso infatti, in queste condizioni si verifica una crescita non controllata di specie batteriche che non riuscirebbero a crescere in condizioni di equilibrio del microbiota, poiché tenute sotto controllo da quelle specie presenti nel microbiota sano ed ora assenti.
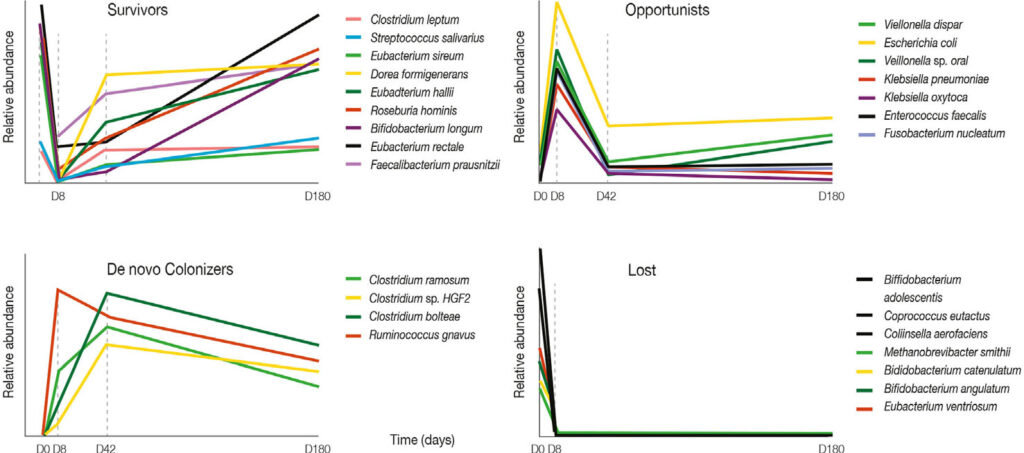
Il primo grafico descrive la presenza di specie che sopravvivono al trattamento antibiotico. Il secondo mostra il comportamento di batteri opportunisti, cioè batteri che normalmente sono presenti nel microbiota, ma che in condizioni di disbiosi possono costituire una minaccia per la salute. Il terzo grafico dà informazioni riguardo al comportamento di nuovi colonizzatori della flora batterica intestinale e l’ultimo mostra invece le specie batteriche perse in seguito al trattamento antibiotico.
Alterazione del metaboloma
Il termine metaboloma indica l’insieme, in continuo cambiamento, dei metaboliti presenti in un organismo. Gli effetti che gli antibiotici esercitano sul metaboloma microbico sono meno chiari rispetto all’impatto esercitato sulla composizione del microbiota. Da studi condotti su giovani topolini, emerge come la somministrazione a basse dosi di antibiotici conduca ad un aumento della massa adiposa e ad un aumento di livelli ormonali associati al metabolismo di carboidrati, lipidi e colesterolo.
Diffusione di antibiotico-resistenze
L’utilizzo indiscriminato e talvolta non necessario di antibiotici fa sì che si selezionino batteri resistenti a tale molecola. Lo sviluppo delle resistenze è connesso con il concetto di evoluzione: quando nell’ambiente insorge uno stress (in questo caso una molecola antibiotica), solamente il batterio adattato a questa nuova condizione è in grado di riprodursi e di sopravvivere.
Il problema dell’antibiotico-resistenza diventerà una delle principali sfide della medicina. Quando un antibiotico risulta inefficace contro un patogeno, si cerca di cambiare molecola. Purtroppo però, si incontrano sempre più frequentemente batteri che hanno sviluppato resistenze multiple a diversi antibiotici, provocando infezioni difficilmente trattabili. Il problema potrebbe essere risolto cercando nuove tipologie di molecole antimicrobiche, ma questa ricerca è lunga e difficile.
I batteri hanno sviluppato diverse strategie per sopravvivere ad un antibiotico: dalla riduzione del passaggio della molecola attraverso la loro parete cellulare, allo sviluppo di enzimi che inattivano e degradano l’antibiotico. Esistono casi in cui la molecola viene attivamente pompata all’esterno della cellula microbica attraverso l’uso di sistemi di efflusso. Esistono casi in cui sopraggiunge una mutazione a carico del target dell’antibiotico, che rende la molecola antimicrobica incapace di riconoscere il suo obbiettivo (si vedano ad esempio le mutazioni a carico delle proteine target delle penicilline, ovvero le Penicillin-Binding Protein). Infine, potrebbe verificarsi anche una generale riduzione della permeabilità della membrana plasmatica del batterio, riducendo l’ingresso dell’antibiotico.
Anche in un microbiota sano esiste generalmente un pool di geni di antibiotico-resistenza, che però aumenta incredibilmente in concomitanza della somministrazione dell’antibiotico.
Conseguenze cliniche dell’utilizzo di antibiotici
Conseguenze a breve e medio termine
Una delle conseguenze cliniche più comuni in seguito ad un trattamento antibiotico è un fenomeno diarroico durante la somministrazione o nelle settimane successive.
In condizioni di omeostasi del microbiota intestinale, la crescita batterica è tenuta sotto controllo da diversi meccanismi, come molecole con funzione antimicrobica prodotte dall’ospite e secrete nello strato di muco presente a livello dell’epitelio intestinale, insieme ad immunoglobuline A prodotte in seguito alla stimolazione del sistema immunitario umano grazie a pattern molecolari presenti sulla superficie dei batteri del microbiota. L’ eliminazione di molte specie batteriche con antibiotici causa una minor presenza di questi profili molecolari, con conseguente riduzione della stimolazione del sistema immunitario e ridotta produzione di molecole antimicrobiche da parte dell’ospite.
Questa situazione può favorire l’insorgenza di patogeni enterici.
L’assunzione di probiotici affiancata al trattamento antibiotico risulta una buona strategia per ridurre l’insorgenza di questi fenomeni diarroici.
In situazioni gravi, l’utilizzo massivo di antibiotici, specialmente in persone anziane, può portare all’insorgenza di infezioni da Clostridium difficile, un batterio difficile da trattare proprio a causa dello sviluppo di resistenze ad antibiotici. Talvolta, in questi casi è necessario ricorrere ad un trapianto di microbiota fecale (leggi l’articolo dedicato).
Conseguenze a lungo termine
Nei bambini, l’utilizzo massiccio e talvolta eccessivo di antibiotici è associato all’insorgenza di patologie nell’età adulta come l’obesità, l’asma, allergie e IBD (Inflammatory Bowel Disease come la colite ulcerosa o il Morbo di Crohn). In particolare, si è riscontrata un’ associazione statisticamente significativa tra queste patologie e l’assunzione di antibiotici nei primi due anni di vita del bambino.
Gli antibiotici costituiscono una delle principali armi a disposizione della medicina per combattere le infezioni batteriche.
Il loro uso, in alcuni casi sconsiderato, provoca pesanti alterazioni al microbiota intestinale, che a sua volta incide pesantemente sul benessere dell’individuo. In più, l’abuso di antibiotici ha favorito la selezione di batteri resistenti che costituiscono una sfida importante per la medicina del futuro.
Da tutto ciò si evince l’importanza dell’utilizzo consapevole di questi farmaci, che hanno rivoluzionato la medicina moderna, aumentando la prospettiva e la qualità di vita in molti paesi del mondo.


Lascia un commento